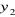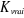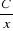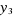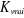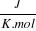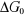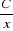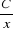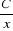TABLE DES MATIERES
DEDICACE...................................................................................................i
AVANT-PROPOS..........................................................................................ii
TABLE DES MATIERES
1
INTRODUCTION
3
CHAPITRE I: GENERALITES
6
I.1. GENERALITES SUR LE MANIOC
6
I.1.1. Historique et origine
6
I.1.2. Description sommaire
6
I.1.3. Composition chimique.
7
I.2. Etude Cinétique .
8
CHAPITRE II. L'ACIDE CYANHYDRIQUE ET LA TOXICITE DU
MANIOC
9
II.1. L'acide cyanhydrique et la toxicité du
manioc
9
II.3. Maladies liées à la
toxicité du manioc .
13
PARTIE EXPERIMENTALE
16
CHAPITRE III. MATERIELS ET METHODE
17
III.1. Matériels
17
III.1.1. Echantillons
17
III.1.2. Appareillage
17
III.2. Méthode
17
IV.1.Détermination des paramètres
cinétiques
23
IV.2. Contribution à l'étude
thermodynamique.
27
IV.2.1. Détermination de la constante de
partage vrai.
27
IV.2.2. Détermination de l'enthalpie
libre
30
CONCLUSION
35
REFERENCES BIBLIOGRAPHIQUES
36
INTRODUCTION
Le manioc est le plus important tubercule tropical
cultivé. Ce tubercule constitue une source majeure d'énergie
diététique pour plus de 500 millions de personnes.
Il est connu comme le meilleur producteur des hydrates de
carbone (sucres) parmi les cultures de produits de base.
Selon FAO, le manioc occupe la 4ème place
des cultures vivrières dans les pays en voie de développement
après le riz, le maïs et le blé. Les feuilles de manioc sont
relativement riches en protéines, vitamines A et B et sont aussi
comestibles.
Selon FAO et IFAD le manioc peut être le point de
départ important pour la croissance dans plusieurs pays si la
diversification de la production et l'utilité commerciale de cet
important tubercule est améliorée. (9)
Le problème majeur est la présence du cyanure
dans le manioc qui est un poison et qui doit être éliminé
avant la consommation. Jusqu'à nos jours, il n' y a pas de
méthode de traitement approprié pour se débarrasser du
cyanure dans le pays en voie de développement tel que la
République Démocratique du Congo.
La consommation du manioc contenant le cyanure conduit
quelques fois à une terrible maladie nerveuse appelée "KONZO" et
aussi provoque-t-elle l'apparition du goitre chez un nombre important de
personnes.
Le KONZO qui signifie en YAKA (une des langues du Bandundu)
jambes fatiguées, est une maladie caractérisée par une
paralysie de deux jambes et la personne atteinte voit ses deux jambes trembler
et s'affaiblir, elle devient incapable de se tenir débout. Il y a
certainement à notre avis une relation entre la présence du
cyanure dans le manioc et cette maladie.
Il y a plusieurs procédés utilisés pour
le traitement du manioc qui donnent différents produits et
dépendent d'une région, d'un pays à l'autre.
En République Démocratique du Congo par exemple,
le manioc est traité avec des techniques traditionnelles ; on a:
les feuilles de manioc pilées, pâte de manioc, croquettes de
manioc, farine de manioc (fufu), chikwangue, purée de manioc,
gâteau de manioc, semoule de manioc, etc. Ces produits
représentent la principale nourriture pour plus de 60% de la
population.
BUT ET INTERET DU
TRAVAIL
Le but principal est de mettre au point un
procédé rapide, stable, sûr de transformation du manioc
avec moins de substances toxiques dans les produits finis.
Notre démarche a consisté à
évaluer le taux de libération de l'acide cyanhydrique dans le
manioc et à proposer quelques conseils pratique pour
l'amélioration des méthodes traditionnelles.
L'intérêt que revêt ce travail comporte
deux aspects; à savoir:
· Sur le plan sanitaire, cette étude contribue
à diminuer les risques d'exposition au cyanure suite à la
consommation régulière du manioc, par l'optimisation du rendement
de la transformation.
· Sur le plan scientifique, ce travail fournit des
renseignements physico-chimiques sûrs et globaux pouvant servir à
la mise au point d'un procédé de transformation industrielle.
Ce travail comporte quatre chapitres, outre l'introduction. Le
premier chapitre présente les généralités sur le
manioc et l'étude cinétique, le deuxième traite de l'acide
cyanhydrique et de la toxicité du manioc, tandis que les deux derniers
chapitres sont réservés aux matériels et méthode et
aux résultats et à leur discussion. Enfin une brève
conclusion achève nos investigations.
PARTIE THEORIQUE
CHAPITRE I: GENERALITES
I.1. GENERALITES SUR
LE MANIOC
I.1.1. Historique et origine
Le manioc originaire de l'Amérique latine a
été découvert en 1558 au bord de fleuve Congo
(République Démocratique du Congo).
Le manioc était introduit en Afrique par les marchands
d'esclave et après atteignit l'Asie au 17ème
siècle.
Après 1850, la culture de manioc augmenta dans les
territoires de l'Afrique de l'Est grâce aux efforts des Européens
et arabes qui reconnurent sa valeur comme pièce de rechange dans les
périodes fréquentes de famine (1).
La production globale a atteint 167,7 millions de tonnes en
1999. D'après FAO cette production sera 208,8 millions de tonnes en l'an
2005 (10).
I.1.2. Description sommaire
Le manioc, Manihot esculenta CRANTZ (Syn.Manihot
utilissima POHL) est une dicotylédone pérenne de la famille
des Euphorbiacées (4).
Ses racines tubéreuses et fasciculées sont
riches en amidon et se conservent longtemps en bon état dans le sol. Les
fleurs de manioc sont en grappe et avortent souvent: d'où la
multiplication se fait par bouturage. Les feuilles sont alternes, à
multiples lobes.
Il existe plus de deux cents espèces de
Manihot dont Manihot glaziovii (Ceara); plante à
caoutchouc et Manihot utilissima (manioc) qui est la plante
vivrière la plus importante de la zone tropicale humide par sa
productivité et sa plasticité (2)
La plante de manioc est connue sous des noms très
divers: Ubi ketela (Indonésie); Manioca (Amérique de langue
espagnole); Mandioca (Brésil); Manioc (Madagascar et Afrique
francophone); Tapioca (Inde, Malaisie); Cassava (région anglophones
d'Afrique, Thaïlande); (9).
En République Démocratique du Congo (R.D.C.), le
manioc s'appelle en langues nationales: Songo (lingala); Mohogo (swahili);
Tshomba (tshiluba) et Madioko (kikongo).
I.1.3. Composition chimique.
La conclusion du «Congrès du manioc et des plantes
tropicales des territoires de l'Union Française » de 1949
mentionnée par Barampama (1992) stipule que la faible proportion des
calories lipidiques apportée par le manioc et l'insuffisance protidique
aussi bien que la médiocre valeur biologique des protéines du
manioc en font un aliment déséquilibré (5).
Pour le même auteur, s'il est vrai que les tubercules de
manioc sont pauvres en matières nutritives, excepté les hydrates
de carbone et certaines vitamines surtout la vitamine C, il ne faut pas perdre
de vue que les feuilles conditionnent d'importantes quantités de
protéine.
Le tableau i ci-dessous donne la répartition des
constituants chimiques dans les différentes parties de la plante de
manioc.
Tableau i: Composition chimique des principales
parties de la plante, en pourcentage de matières sèches
(13)
|
Constituants chimiques (%)*
|
PARTIES DE LA PLANTE
|
|
Racine entière
|
Ecorce
|
Cylindre centrale
|
Tige
|
Feuille
|
|
Matière sèche
|
35
|
30
|
40
|
30
|
15
|
|
Glucides
|
89
|
75
|
91
|
48
|
41
|
|
Lipides
|
1
|
2
|
0,5
|
9
|
6
|
|
Protides
|
2,5
|
4
|
2
|
10
|
25
|
|
Fibres
|
4,5
|
12
|
4
|
23
|
20
|
|
Cendres
|
3
|
5
|
2,5
|
10
|
8
|
|
Calcium
|
0,1
|
0,2
|
0,1
|
0,3
|
1,4
|
|
Phosphore
|
0,001
|
0,1
|
0,1
|
0,3
|
0,5
|
|
Fer
|
0,003
|
0,2
|
0,001
|
-
|
0,03
|
|
Sodium
|
0006
|
-
|
-
|
-
|
0,02
|
|
Potassium
|
1
|
-
|
-
|
-
|
2
|
|
Â-Carotène (mg)
|
-
|
-
|
-
|
-
|
30
|
|
Thiamine
|
0,1
|
-
|
-
|
-
|
1
|
|
Riboflavine
|
0,1
|
-
|
-
|
-
|
2
|
|
Niacine
|
1,5
|
-
|
-
|
-
|
8
|
|
Acide ascorbique
|
80
|
-
|
-
|
-
|
500
|
* Sauf, autre indication
I.2. Etude Cinétique (19).
Dans une étude cinétique, il est question de
déterminer la loi de vitesse qui est liée au processus que l'on
étudie. Pour ce faire, on détermine certains paramètres
comme l'ordre de la réaction, la constante de vitesse...
Prenons comme cas illustratif un processus qui obéit
à l'ordre 1 c'est-à-dire un processus pour lequel la vitesse ne
dépend, à température constante, seulement de la
concentration d'une entité réactionnelle.
k
Soit une réaction de premier ordre :
A B
Si  et et  sont
respectivement ; la formalité de B, la formalité de A, la
concentration actuelle de a et la concentration actuelle de b : sont
respectivement ; la formalité de B, la formalité de A, la
concentration actuelle de a et la concentration actuelle de b :
Au temps t=0 :  et et  (1)
(1)
Et au temps t>0 :  et et  (2)
(2)
La vitesse de formation de B
est :  (3)
(3)
En intégrant cette vitesse,
on obtient :  (4)
(4)
Aux les conditions initiales, x=0
pour t=0, on obtient :  (5) (5)
On obtient enfin pour la loi de
vitesse de réaction de premier ordre :
 (6)
(6)
k est la constante de vitesse.
L'équation (6) peut
s'écrire aussi :  ou ou  (7) (7)
Ou encore 
Les équations écrites en (6) donnent l'allure
des courbes de formation de B et de disparition de A.
CHAPITRE II. L'ACIDE CYANHYDRIQUE
ET LA TOXICITE DU MANIOC
II.1. L'acide cyanhydrique et la
toxicité du manioc
Cet acide ne se trouve pas à l'état libre dans
les tissus végétaux, mais sous forme de composés chimiques
qui peuvent être des glycosides cyanogénétiques ou des
cyanolipides.
Les glycosides cyanogénétiques sont des â-
glycosides constitués d'un sucre non hydrolysable et d'un
aglycone : linamarine et lotaustraline ( ou
méthyllinamarine).(Monique L, et. Al ; 1992)
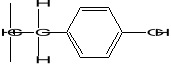
Le principe toxique essentiel qui existe en quantités
variables dans toutes les parties de la plante de manioc est un composé
chimique appelé linamarine. Il coexiste souvent avec son homologue
méthylique appelé méthyllinamarine ou lotaustraline.
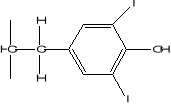
Figure 1: Structure des glucosides
cyanogénétiques de manioc (15)
 
LINAMARINE
LOTAUSTRALINE
Identiques sur le plan de la qualité, ces glucosides
sont présents dans le manioc dans le rapport 93% à 97% pour la
linamaroside contre 7 à 3% de la lotaustraloside (6)
Leur biosynthèse semble impliquer l'acide aminé
L-valine pour la linamaroside et l'acide aminé L-isoleucine pour la
lotaustraloside comme précurseurs, selon le schéma proposé
par Conn et Butler, mentionnés par Rukiya (1988).
Figure 2: Etapes de la
biosynthèse d'un glucoside cyanogénétique (11)



Amino acide
N-Hydroxylaminoacide Aldoxime



Nitrile á -
Hydroxynitrile glucoside
cyanogénétique
La linamarine est un glucoside cyanogénétique
qui est transformé en acide cyanhydrique toxique ou acide prussique
lorsqu'il entre en contact avec la linamarase, une enzyme qui est
libérée quand les cellules des racines de manioc se rompent a
linamarase est une enzyme endogène qui a son optimum d'activité
à pH 5,5 - 6. Elle est détruite à72°C. c'est une
ß- glucosidase (Bourdoux et al ; 1980)
Figure 3: Dégradation
enzymatique de la linamarine (4)
+
Linamarase
+ H2O

 
Linamarine
Glucose
Cyanohydrine
Oxynitrilase
+ HCN

Acetone
acide cyanhydrique
La linamarine est par ailleurs un composé assez stable
qui n'est pas modifié durant la cuisson du manioc. Si elle passe de
l'intestin dans le sang comme glucoside intact, elle est probablement
excrétée inchangée dans l'urine sans dommage pour
l'organisme (Philbrick, et al. 1977).
Cependant la linamarine ingérée peut
libérer du cyanure dans l'intestin durant la digestion.
L'acide cyanhydrique (HCN) est un composé volatil. Il
s'évapore rapidement dans l'air à des températures
supérieures à 28°C et se dissout facilement dans l'eau. Il
peut aisément être perdu durant le transport, l'entreposage et
l'analyse des échantillons. La teneur normale en cyanogène des
tubercules de manioc se situe normalement entre 15 et 400 mg de HCN/kg de poids
frais (7).
La concentration varie largement entre les
variétés de même qu'avec les conditions écologiques
et culturelles. La concentration des glucosides cyanogénétiques
augmente du centre vers la périphérie du tubercule (Bruijn,
1973). Généralement, la teneur en cyanure est beaucoup plus
élevée dans la peau (écorce) du manioc.
Les méthodes traditionnelles de transformation et de
cuisson du manioc. Si elles sont appliquées avec soin, peuvent
réduire la teneur en cyanure jusqu'à des niveaux non toxiques.
Une méthode de transformation efficace libérera
la linamarase en désintégrant la microstructure de la racine de
manioc. En amenant cette enzyme en contact avec la linamarine, le glucoside est
transformé en acide hydrocyanique. Le cyanure libéré se
dissout dans l'eau quand la fermentation est provoquée par un trempage
prolongé et s'évapore quand le manioc fermenté est
séché.
Le séchage au soleil de petits morceaux de manioc frais
pendant une courte durée n'est pas un bon procédé de
détoxication. Le cyanure ne sera pas complètement
libéré et l'enzyme sera détruite pendant le
séchage.
Les techniques de transformation par séchage au soleil
ne réduisent que de 60% à 70% la teneur totale en cyanure durant
les deux premiers mois de conservation. Les résidus de cyanure peuvent
être très importants dans les tubercules secs, de 30 à 100
mg/kg (Casadei, 1988). La simple cuisson à l'eau de morceaux de racine
fraîche n'est pas toujours une garantie de non-toxicité car le
cyanure ne pourrait être que partiellement libéré, et une
fraction seulement de la linamarine passerait dans l'eau de cuisson.
La réduction des cyanures varie si le produit est mis
dans l'eau froide (27°C) ou directement dans l'eau bouillante
(100°C).
Après 30 minutes de cuisson, les cyanures ne sont plus,
dans le premier cas, que 8% de leur valeur initiale, et dans le seconde cas
environ 30% (Essers, 1986).
Plusieurs auteurs ont suggéré différents
niveaux minimaux pour la toxicité. Rosling (1987) a exprimé
l'opinion qu'une dose de plus de 20 mg pour 100 g de manioc est toxique, tandis
que Bolhis (1954) a établi la dose toxique de 50 à 60 mg par
jour pour un adulte Européen.
II.2. Détoxication de
l'acide cyanhydrique dans l'organisme
Le cyanure est détoxiqué dans l'organisme par la
conversion en thiocyanate, un composé soufré ayant des
propriétés goitrigènes.
Les substrats essentiels pour la conversion du cyanure en
thiocyanate sont le thiosulfate et 3-mercapto-pyruvate dérivés
principalement de la cystéine, de la cystine et de la méthionine,
les acides aminés contenant du soufre.
La vitamine B12 sous la forme d'hydroxycolabamine influence
vraisemblablement la conversion du cyanure en thiocyanate.
L'hydroxycolabamine augmenterait l'excrétion par voie
urinaire de thiocyanate chez des animaux expérimentaux ayant
ingéré de petites doses de cyanure (Wokes et Picard, 1955; Smith
et Duchett, 1965). De 60 à 100% du cyanure injecté en
concentration toxique sont transformés en thiocyanate en l'espace de 20
heures et la transformation enzymatique représente plus de 80% de la
détoxication du cyanure (Wood et Cooley, 1956).
Le thiocyanate est largement distribué dans les
liquides du corps, y compris la salive, dans laquelle il peut facilement
être détecté.
Chez l'homme en bonne santé un équilibre
dynamique entre le cyanure et le thiocyanate est maintenu. Un régime
pauvre en protéines, particulièrement un régime dans
lequel les acides aminés soufrés font défaut peut
réduire la capacité de détoxication et rendre ainsi une
personne plus vulnérable à l'effet toxique du cyanure (15).
La consommation excessive de manioc comme source unique
d'énergie alimentaire et source principale de protéines, pourrait
donc accentuer la sensibilité à la toxicité du cyanure.
II.3. Maladies liées
à la toxicité du manioc (3).
Plusieurs maladies ont été associées aux
effets toxiques du manioc. Ceci a été confirmé dans
l'état pathologique de l'intoxication aiguë par le cyanure et dans
le goitre.
L'organisme peut sans danger détoxiquer à peu
près 20 mg de cyanure par jour, mais si ce niveau augmente pour
atteindre 30 mg, des symptômes d'intoxication aiguë apparaissent
chez la plupart des consommateurs, et commence alors
l'épidémie.
L'augmentation du thiocyanate, thiosulfate dans le sang bloque
l'iode et l'empêche d'entrer dans la thyroïde pour former les
hormones thyroïdiennes (T3 et T4). Ceci
entraîne donc le goitre dû à l'hypothyroïdie.
L'hypothyroïdie est une affection qui a des
répercussions directes sur la santé, l'intelligence et le
développement harmonieux de l'organisme humain.
Cette carence en iode empêche donc la production des
hormones thyroïdiennes notamment T3 et T4 dont les
actions multiples peuvent être classés en 2 groupes:
1. Action sur le développement de l'organisme
(croissance et différenciation).
- In utero, les hormones thyroïdiennes sont essentielles
pour la différenciation et la maturation des tissus foetaux.
- Après la naissance, ces hormones sont indispensables
à la croissance du squelette et d'à peu près tous les
organes, ainsi qu'au développement du système nerveux central.
Une insuffisance thyroïdienne commencée pendant la
vie foetale ou à la naissance (hypothyroïdie congénitale ou
hypothyroïdie néonatale) entraîne une hypotrophie des
neurones corticaux. Cela aboutit à l'insuffisance du
développement du cerveau et conduit aux lésions
définitives de celui-ci (crétinisme mental).
2. Régulation de l'activité métabolique
et action viscérale:
- Les hormones thyroïdiennes contrôlent le
métabolisme des glucides, des lipides, de l'azote et surtout, la
calorigènèse. Elles constituent un fantastique
accélérateur du métabolisme de l'organisme.
- Les hormones thyroïdiennes règlent la vitesse
des réactions enzymatiques par agénésie de la glande
thyroïde aboutit au nanisme et au crétinisme.
Le crétinisme est toujours présent dans les
régions où le goitre est endémique.
L'ingestion du cyanure présent dans les aliments
conduit à sa détoxication dans l'organisme grâce à
la production de thiocyanate. Le thiocyanate a la même taille
moléculaire que l'iode et intervient sur la dose d'iode par la glande
thyroïde (Bourdoux et al., 1978).
En cas d'ingestion de quantités importantes de manioc
insuffisamment traité, il peut y avoir une surcharge chronique de
cyanure conduisant à une élévation du niveau de
thiocyanate dans le sérum qui passe à 1-3 mg/100ml le niveau
normal étant d'environ 0,2 mg/100 ml. Dans de telles conditions, la
présence d'une excrétion accrue d'iode et d'une absorption
réduite d'iode par la glande thyroïde aboutit à un rapport
d'excrétion thiocyanate/iode (SCN/I) faible. Il semble que si ce rapport
dépasse trois, le goitre endémique apparaît (7). Ce
phénomène ne peut se produire que si la dose d'iode est
inférieure à 100 mg/jour.
Quand le rapport SCN/I est inférieur à deux, il
existe un risque de crétinisme endémique, état
caractérisé par une grave arriération mentale et des
anomalies neurologiques (Erman et al., 1983).
Des études réalisées en R.D.C. (ex.
Zaïre) ont montré que les habitants d'Ubangi, qui consomment de
grandes quantités de manioc séché au soleil mais non
fermenté, présentent un rapport SCN/I faible allant de deux
à quatre et sont atteints de goitre endémique et de
crétinisme.
Mais à Kinshasa la capitale, où les habitants
mangent de la pâte de manioc fermentée et séchée, le
rapport SCN/I passe de trois à cinq et les cas de goitre sont peu
fréquents.
Un faible rapport conduit à des quantités
anormales de l'hormone stimulant la thyroïde et à de petites
quantités de thyroxine (T4).
Ayangade et al. (1982) ont constaté que chez les femmes
enceintes, le niveau de thiocyanate dans le sang du cordon était
proportionnel à celui du thiocyanate dans le sérum maternel,
indiquant que le thiocyanate dans le lait maternel, ce qui indique que les
glandes mammaires ne concentrent pas le thiocyanate et les enfants nourris au
sein ne sont pas affectés.
Quand des suppléments d'iode sont donnés par
exemple, par l'adjonction d'iodure de potassium aux réserves locales de
sel, le goitre est réduit malgré une injection
élevée et continue de produits dérivés du
manioc.
Là où la ration de sel est modérée
ou variable, l'huile iodée, absorbée par voie orale, fournit une
protection pour un ou deux ans.
Dans la jungle amazonienne, certains indigènes
consomment jusqu'à 1 kg de manioc frais cuit par jour et jusqu'à
trois litres de bière de manioc fermenté, mais on n'a pas
signalé de cas de goitre ou de neuropathie ataxique. Ces tribus
consomment aussi d'énormes quantités de protéines animales
et de protéines de poisson et trouvent ainsi dans leur alimentation un
rapport important d'acides aminés soufrés et d'iode.
PARTIE EXPERIMENTALE
CHAPITRE III. MATERIELS ET
METHODE
III.1. Matériels
III.1.1. Echantillons
Nous avons utilisé deux variétés de
manioc le SADISA (frais et sec) et le MVUAMA (sec), qui étaient à
leurs 6ème jour après récolte.
Ces tubercules provenaient de la station de MVUAZI dans le
Bas-Congo et nous étaient parvenus par le truchement de l'INERA.
III.1.2. Appareillage
Pour arriver aux résultats que nous présentons,
nous avons utilisé les appareils suivants:
- un dispositif de distillation par entraînement
à la vapeur (deux ballons de distillation connectés en
série un réfrigérant, un erlenmeyer);
- des pipettes de 10 ml;
- des pieds gradués de 50 ml;
- une plaque chauffante;
- un thermomètre;
- des ballons de 250 ml ;
- Une balance Mettler AE 10 ;
III.2. Méthode
Pour déterminer quantitativement le taux de cyanure
dans les tubercules de manioc, nous avons utilisé la méthode
argentimétrique (méthode de titrage au nitrate d'Argent) et cela
en nous inspirant de la méthode décrite par BRUDZYNSKI (1982)
(6).
a. Principe
L'acide cyanhydrique libéré par hydrolyse
enzymatique est entraîné par la vapeur d'eau;
récupéré dans une solution alcaline et titré par
argentimétrie.
La réaction principale pendant la titration est la
suivante:
2 CN- + Ag+
[Ag(CN)2]-
L'on observe par contre que l'ion
[Ag(CN)2]- formé a tendance à se combiner
avec l'ion Ag+ à chaque addition de AgNO3; pour
former un précipité.
[Ag(CN)2]- + Ag+
Ag[Ag(CN)2]
Cette combinaison est rendue impossible étant
donné la présence d'un excès de NH4OH, qui
solubilise l'argento-cyanure d'argent.
L'on atteint la fin de la réaction lorsque tous les
ions CN- ont été liés. A cet instant, le
surplus d'Ag+ se combine aux ions I- contenus dans le
milieu réactionnel; suite à son insolubilité dans le
NH4OH, l'AgI précipite préférentiellement en
laissant un trouble (blanchâtre au jaunâtre) dans le
milieu.
b. Réactifs
Les différents réactifs utilisés ont
été préparés au laboratoire, soit par la
méthode de dilution, soit par la méthode de pesée. Ainsi
les différents réactifs sont :
- AgNO3 0, 1 M ;
- NaOH 0,75 M ;
- NH4OH 13 M ;
- KI 0,3 M.
C. Mode opératoire
- Dans dix ballons de 250 ml, râper 50 g de
matière fraîche ou sèche (manioc) et remplir d'eau jusqu'au
trait de jauge ;
- Après chaque intervalle de temps de 7 heures,
prendre un échantillon dans lequel l'on prélève 100 ml de
solution que l'on distille par entraînement à la vapeur pour
récupérer l'acide cyanhydrique libéré par
hydrolyse. Le deuxième échantillon est traité après
14 heures et ainsi de suite ;
- Le distillat est recueilli dans un erlenmeyer de 100 ml
contenant 5 ml de NaOH 0,75 M ;
- On arrête la distillation lorsqu'on atteint environ
10 ml de distillat ;
- Ensuite, on ajoute 5 gouttes de NH4OH et 2
gouttes de KI avant le titrage au AgNO3 0,1 M.
Ce titrage se fait sur fond noir afin de bien observer
l'opalescence due à la formation de AgI.
Dans l'essai à blanc, le distillat est remplacé
par l'eau distillée.
La différence des quantités: (ml) de
AgNO3 utilisé pour le titrage de l'échantillon, et
(ml) utilisé pour le blanc (eau distillée) indique la
quantité de cyanure dans l'échantillon.
Pour chaque échantillon, trois titrages sont
réalisés.
d. Calcul
D'après la réaction de titrage:
2 NaCN + AgNO3 NaCN.AgCN +
NaNO3; l'on constate que :
1 mole de Ag+ réagit avec 2 moles de
CN-, donc ;
107,85 g de Ag+ 1 M neutralisent 2 x 26,018 g de
CN-, autrement dit; 1000 ml de Ag+ 1 M neutraliseront
52,04 g de CN-.
Dans ce cas 1000 ml de Ag+ 0,1 M neutraliseront
 g de
CN-. g de
CN-.
Donc, 1 ml de Ag+ 0,1M
neutralise 5,204 mg de CN-.
Le cyanure résulte d'une réaction enzymatique
qui se passe en deux phases :
- Dans la première phase, la linamarine subit une
hydrolyse enzymatique pour donner le cyanohydrine, selon :
1.
+ H2O
Linamarase
+

 
Linamarine
Glucose
Cyanohydrine
- Dans la deuxième phase, la cyanohydrine est
oxydé en acétone avec libération de l'acide
cyanhydrique :
+ HCN
Oxynitrilase
2.
 
Cyanohydrine
Acetone acide cyanhydrique
Notons que l'amertume du manioc est due à la
présence simultanée de l'enzyme linamarase qui hydrolyse les
glucosides cyanogénétiques contenus dans le tubercule et de l'ion
cyanure qui est un puissant inhibiteur de la chaîne respiratoire
(Rukiya).
CHAPITRE IV: RESULTATS ET
DISCUSSIONS
Nous donnons dans les tableaux 1, 2, 3 ci-dessous les valeurs
des concentrations du cyanure dans les variétés de manioc SADISA
et MVUAMA provenant de MVUAZI dans la province du Bas-Congo, obtenus par
argentimétrie.
Ces concentrations ont été mesurées
chaque fois après 7 heures et ce pendant 3 jours.
Tableau 1: Concentrations de cyanure dans le
manioc frais, type SADISA en milligramme de cyanure par kilogramme de manioc
(mg/kg).
N°
|
Temps de trempage
|
Volume de AgNO3 en ml
|
Concentration du CN- en mg/kg
|
|
2ème essai
|
3ème essai
|
Moyenne
|
|
07 heures
|
0,5
|
0,6
|
0,6
|
0,56#177;0,06
|
145,712#177;0,050
|
2
|
14 heures
|
0,7
|
0,6
|
0,7
|
0,66#177;0,06
|
171,732#177;0,050
|
3
|
21 heures
|
0,8
|
0,9
|
0,9
|
0,86#177;0,06
|
223,772#177;0,050
|
4
|
28 heures
|
0,9
|
1,0
|
0,9
|
0,93#177;0,06
|
241,986#177;0,050
|
5
|
35 heures
|
1,2
|
1,2
|
1,3
|
1,23#177;0,06
|
320,046#177;0,050
|
6
|
42 heures
|
1,4
|
1,4
|
1,5
|
1,43#177;0,06
|
372.086#177;0,050
|
7
|
49 heures
|
1,5
|
1,4
|
1,5
|
1,47#177;0,06
|
382,494#177;0,050
|
8
|
56 heures
|
1,5
|
1,4
|
1,5
|
1,47#177;0,06
|
382.494#177;0,050
|
9
|
63 heures
|
1,5
|
1,6
|
1,5
|
1,53#177;0,06
|
398,106#177;0,050
|
10
|
70 heures
|
1,5
|
1,5
|
1,6
|
1,53#177;0,06
|
398,106#177;0,050
|
|
Tableau 2. Concentration de cyanure dans le manioc
séché type SADISA en mg de cyanure par kg de manioc
(mg/kg)
N°
|
Temps de trempage
|
Volume de AgNO3 en ml
|
Concentration du CN- en mg/kg
|
|
2ème essai
|
3ème essai
|
Moyenne
|
|
07 heures
|
0,3
|
0,2
|
0,3
|
0,26#177;0,06
|
67,652#177;0,050
|
2
|
14 heures
|
0,3
|
0,3
|
0,4
|
0,33#177;0,06
|
85,866#177;0,050
|
3
|
21 heures
|
0,4
|
0,4
|
0,3
|
0,36#177;0,06
|
93,672#177;0,050
|
4
|
28 heures
|
0,4
|
0,4
|
0,5
|
0,43#177;0,06
|
111,886#177;0,050
|
5
|
35 heures
|
0,6
|
0,5
|
0,5
|
0,53#177;0,06
|
137,906#177;0,050
|
6
|
42 heures
|
0,5
|
0,6
|
0,6
|
0,56#177;0,06
|
145,712#177;0,050
|
7
|
49 heures
|
0,6
|
0,6
|
0,7
|
0,63#177;0,06
|
163,926#177;0,050
|
8
|
56 heures
|
0,7
|
0,7
|
0,8
|
0,73#177;0,06
|
189,946#177;0,050
|
9
|
63 heures
|
0,7
|
0,8
|
0,7
|
0,73#177;0,06
|
189,946#177;0,050
|
10
|
70 heures
|
0,8
|
0,8
|
0,7
|
0,73#177;0,06
|
189,946#177;0,050
|
|
Tableau 3. Concentration de cyanure dans le
manioc séché type MVUAMA en mg de cyanure par kg de manioc
(mg/kg).
N°
|
Temps de trempage
|
Volume de AgNO3 en ml
|
Concentration du CN- en mg/kg
|
|
2ème essai
|
3ème essai
|
Moyenne
|
|
07 heures
|
0,1
|
0,1
|
0,2
|
0,13#177;0,06
|
33,826#177;0,050
|
2
|
14 heures
|
0,1
|
0,2
|
0,2
|
0,16#177;0,06
|
41,632#177;0,050
|
3
|
21 heures
|
0,2
|
0,3
|
0,3
|
0,26#177;0,06
|
67,652#177;0,050
|
4
|
28 heures
|
0,3
|
0,4
|
0,3
|
0,33#177;0,06
|
85,866#177;0,050
|
5
|
35 heures
|
0,3
|
0,4
|
0,4
|
0,36#177;0,06
|
93,672#177;0,050
|
6
|
42 heures
|
0,5
|
0,5
|
0,6
|
0,53#177;0,06
|
137,906#177;0,050
|
7
|
49 heures
|
0,6
|
0,5
|
0,6
|
0,56#177;0,06
|
145,712#177;0,050
|
8
|
56 heures
|
0,6
|
0,6
|
0,7
|
0,63#177;0,06
|
163,926#177;0,050
|
9
|
63 heures
|
0,6
|
0,7
|
0,6
|
0,63#177;0,06
|
163,926#177;0,050
|
10
|
70 heures
|
0,6
|
0,6
|
0,7
|
0,63#177;0,06
|
163,926#177;0,050
|
|
- A la lumière des tableaux 1, 2 et 3, l'on constate
que la concentration du cyanure augmente avec le temps de trempage et l'on
atteint un palier pour le SADISA frais après 63 heures de trempage et
pour le SADISA sec et le MVUAMA sec après 56 heures de trempage. Ceci
peut se comprendre non seulement par le fait que le maximum de cyanure a
été éliminé, mais aussi par le fait de
l'augmentation de la concentration en acide et donc de la diminution du pH, car
en milieu acide (pH 4 ou moins), la décomposition de la cyanohydrine est
bloqué et il devient stable (Cooke, 1978).
- Les variétés SADISA et MVUAMA secs ont subit
un séchage court à 60°C dans l'étuve, ce qui justifie
leurs faibles teneur par rapport à la variété
fraîche (Cooke et Maduagwu, 1978). Ces résultats sont en accord
avec ceux de Hahn (1983) qui a également confirmé le fait que le
cyanure dans le manioc peut être réduit par séchage au
soleil ou par friture.
- De manière générale, la teneur normale
en cyanure d'après Coursey se situe entre 15 et 400 mg/kg de poids frais
et les résidus du cyanure peuvent d'après Casadei être
très importants dans les tubercules secs, de 30 à 100 mg/kg
(7).
La base de la classification des variétés de
manioc est fondée sur la teneur en acide cyanhydrique qu'elles
contiennent (18):
· Variété douce : 50 mg de HCN/kg de
matières fraîches ;
· Variété amère : plus de 50
mg de HCN/kg de matières fraîches.
Rulhand et Bolhius adoptent la classification
suivante :
· Variété douce : 50 mg HCN/kg de
matières fraîches ;
· Variété intermédiaire : 50
à 100 mg de HCN/kg de matières fraîches ;
· Variété amère :> 100 mg
HCN/kg de matières fraîches.
Nos résultats confirment ainsi le fait que nos
tubercules aient été amers.
IV.1.Détermination
des paramètres cinétiques
Dans une étude des réactions chimique, il
s'agit généralement de répondre à un certain nombre
de questions dont celles de savoir : comment se présente le
schéma réactionnel?, à quelle vitesse se déroule la
réaction ?, quel est l'ordre de réaction ?, quand est
ce qu'on atteint l'équilibre?...dans le but d'établir les lois de
vitesse liées à ce processus.
C'est à ces questions que nous essayons de
répondre concernant l'équilibre que nous étudions.
Notons que pour étudier le mécanisme
réactionnel, on étudie le nombre d'étapes
élémentaires d'une réaction et la détermination de
k permet de dénombrer les lois de vitesse d'une réaction.
L'ordre de réaction par contre, c'est la somme des
exposants dans la loi de vitesse. Les résultats expérimentaux
montrent qu'en général, la vitesse de réaction
dépend d'une certaine manière des concentrations des
espèces réagissantes. L'ordre de réaction donne alors
l'expression de cette dépendance.
Cinétique
enzymatique
Comme la réaction que nous étudions est une
réaction enzymatique, il aurait été mieux de faire une
cinétique enzymatique dont l'équation de base (équation de
Michaelis Menten) est :

Avec:
·  : Vitesse maximum d'une réaction, qui est obtenue pour des fortes
concentrations en substrat, lorsque l'enzyme est saturée ; : Vitesse maximum d'une réaction, qui est obtenue pour des fortes
concentrations en substrat, lorsque l'enzyme est saturée ;
·  : Vitesse initiale de la réaction ; : Vitesse initiale de la réaction ;
·  : Constante de Michaelis, c'est la concentration en substrat pour
laquelle la vitesse de la réaction est égale à la
moitié de la vitesse maximum ; : Constante de Michaelis, c'est la concentration en substrat pour
laquelle la vitesse de la réaction est égale à la
moitié de la vitesse maximum ;
·  : Concentration du substrat. : Concentration du substrat.
Notons que, la détermination de ces grandeurs exige
qu'on varie la concentration du substrat en laissant intact celle de l'enzyme
(l'objectif étant de saturer tous les sites actifs de l'enzyme, cela en
vue d'atteindre la vitesse maximale de la réaction catalysée par
l'enzyme.
Il ne nous a pas été facile de le faire, car la
linamarase est produite par l'échantillon lui-même, n'ayant pas le
contrôle de l'enzyme, nous n'avons pu varier la concentration du substrat
(linamarine) en maintenant la quantité de l'enzyme constante en vue
d'atteindre  et de
faire ainsi une cinétique enzymatique. et de
faire ainsi une cinétique enzymatique.
Voilà pourquoi, nous nous sommes rabattu à la
cinétique formelle.

Figure 4 : Allure des courbes donnant la
variation de la concentration du cyanure dans les variétés de
manioc SADISA (frais), SADISA (sec) et MVUAMA (sec) en fonction du
temps.
a. SADISA frais
|
Temps (heure)
|
C
|
x
|
C - x
|
|
|
|
7
14
21
28
|
398,106
398,106
398,106
398,106
|
145,712
171,732
223,772
241,986
|
252,394
226,374
174,334
156,120
|
0,00396
0,00442
0,00574
0,00641
|
-2,402
-2,355
-2,241
-2,194
|
|
k
|
0,024242#177;0,003105 h-1
|

b. SADISA sec
|
Temps
(heure)
|
C
|
x
|
C - x
|
|
|
|
7
14
21
28
|
189,946
189,946
189,946
189,946
|
67,652
85,866
93,672
111,886
|
122,294
104,080
96,274
78,060
|
0,0080
0,0096
0,0104
0,0128
|
-2,087
-2,017
-1,984
-1,892
|
|
k
|
0,020309#177;0,002507 h-1
|

c. MVUAMA sec
|
Temps (heure)
|
C
|
x
|
C - x
|
|
|
|
7
14
21
28
|
163,926
163,926
163,926
163,926
|
33,826
41,632
67,652
85,866
|
130,100
122,294
96,274
78,060
|
0,0076
0,0082
0,0104
0,0128
|
-2,114
-2,087
-1,984
-1,892
|
|
k
|
0,025277#177;0,003933 h-1
|

La constante de vitesse
«k» est obtenu en portent  en fonction
de temps en utilisant le programme origin 6.1. sur ordinateur. en fonction
de temps en utilisant le programme origin 6.1. sur ordinateur.
Détermination du
temps de demie vie ( 1/2) 1/2)
Le temps de demie vie sera pour
nous le temps de demie extraction, ce qui correspond à la moitié
de la concentration totale du cyanure dosable ou extractible.
Notons, cependant que le temps de
demie vie pour une réaction de premier ordre s'écrit :

Les résultats obtenus sont repris dans le tableau 4:
Tableau 4. Temps de demie vie de l'élimination du
cyanure dans les variétés de manioc SADISA (frais), SADISA (sec)
et MVUAMA (sec).
|
Echantillons
|
Constante de vitesse
(heure-1)
|
Temps de demie vie
(heure)
|
|
SADISA (frais)
SADISA (sec)
MVUAMA (sec)
|
0,024242#177;0,003105
0,020309#177;0,002507
0,025277#177;0,003933
|
28,587 h
34,123 h
27,416 h
|
N.B. : Le temps de demie vie pour l'ordre 1 est
indépendant de la concentration des entités
réactionnelles.
IV.2. Contribution à
l'étude thermodynamique.
Dans l'étude thermodynamique, nous nous sommes
limité à la détermination de la constante
d'équilibre de partage vrai ( ) et à celle de
l'enthalpie libre standard ( ) et à celle de
l'enthalpie libre standard ( ) lié au
processus. ) lié au
processus.
IV.2.1. Détermination de la
constante de partage vrai.
L'élimination du cyanure dans le manioc est un
équilibre de partage entre deux phases : la phase solide
constituée du manioc et la phase aqueuse.
Le cyanure sous forme glucosique et non glucosique est
libéré après hydrolyse enzymatique du manioc.
Le cyanure libéré dans le manioc passe en
solution aqueuse par diffusion, donc l'élimination du cyanure sera
limitée par le phénomène de diffusion et l'action
enzymatique.
L'action enzymatique s'estompe à pH = 4, seule la
diffusion gouverne la réaction d'élimination.
Pour déterminer la constante de partage vrai ;
définissons les termes suivants :
·  : est la formalité du cyanure dans la phase
solide ; : est la formalité du cyanure dans la phase
solide ;
·  = x : est la formalité du cyanure dans la phase aqueuse ; = x : est la formalité du cyanure dans la phase aqueuse ;
·  : est la concentration actuelle du cyanure libre dans la phase
solide ; : est la concentration actuelle du cyanure libre dans la phase
solide ;
·  : est la concentration actuelle du cyanure lié dans la
phase solide ; : est la concentration actuelle du cyanure lié dans la
phase solide ;
·  : est la concentration actuelle du cyanure dans
la phase aqueuse. : est la concentration actuelle du cyanure dans
la phase aqueuse.
Si :  (i) (i)
 (ii)
(ii)
Et que la constante d'équilibre (de
partage) vrai est donnée par :
 (1) (1)
La constante de partage apparente :
 (2)
(2)
En remplaçant (i) et (ii)
dans (2), et en considérant l'inverse de Kapp , on
obtient :


On obtient une droite en portant sur graphique  en fonction de en fonction de  dont l'ordonnée
à l'origine nous donne ( dont l'ordonnée
à l'origine nous donne ( ) ce qui nous
permet d'obtenir la constante de partage vraie par la relation : ) ce qui nous
permet d'obtenir la constante de partage vraie par la relation : 
Les tableaux 5, 6, 7 donnent les résultats obtenus
après calcul :
Tableau 5.Valeurs de  pour le SADISA (frais)
pour le SADISA (frais)
|
x
|
C
|
|
|
|
145,712
171,732
223,772
241,986
320,046
372,086
|
398,106
398,106
398,106
398,106
398,106
398,106
|
2,732
2,318
1,780
1,645
1,244
1,069
|
0,007
0,006
0,005
0,004
0,003
0,003
|
En faisant la régression
linéaire sur ordinateur, nous avons :
L'équation de la droite :  =
0,011+383,025x1 ; =
0,011+383,025x1 ;
Le coefficient de
corrélation : R2 = 0,97569;

: 1,0110,050
Tableau 6. Valeurs de  pour le SADISA (sec)
pour le SADISA (sec)
|
x
|
C
|
|
|
|
67,652
85,866
93,672
111,886
137,906
145,712
|
189,946
189,946
189,946
189,946
189,946
189,946
|
2,808
2,212
2,028
1,698
1,377
1,304
|
0,015
0,012
0,011
0,009
0,007
0,007
|
En faisant la
régression linéaire sur ordinateur, nous avons :
L'équation de la droite :  = 0,063+181,157x; = 0,063+181,157x;
Le coefficient de
corrélation : R2=0,99688;

: 1,06730,050
Tableau 7. Valeurs de  pour le MVUAMA
(sec) pour le MVUAMA
(sec)
|
x
|
C
|
|
|
|
33,826
41,632
67,652
85,866
93,672
137,906
|
163,926
163,926
163,926
163,926
163,926
163,926
|
4,846
3,938
2,423
1,909
1,751
1,189
|
0,030
0,024
0,015
0,012
0,011
0,007
|
En faisant la
régression linéaire sur ordinateur, nous avons :
L'équation de la droite :  = 0,003+162,005x; = 0,003+162,005x;
Le coefficient de
corrélation : R2=0,99922 ;

: 1,0030,050
Nous obtenons des pentes négatives parce que la
concentration du cyanure lié dans le  solide est une fonction
décroissante du temps. solide est une fonction
décroissante du temps.
IV.2.2. Détermination de
l'enthalpie libre
A l'équilibre, l'enthalpie
libre standard liée au processus est donnée par :

La température de travail était de 27°C ou
encore 300 K, R vaut 8,314  . Les valeurs de . Les valeurs de   calculées sont
consignés dans le tableau 8 ci-dessous : calculées sont
consignés dans le tableau 8 ci-dessous :
Tableau 8. Valeurs d'enthalpie libre
calculées.
|
Variété
|
|
|
SADISA (frais)
SADISA (sec)
MVUAMA (sec)
|
- 27,286#177;0,050
- 161,751#177;0,050
- 7,471#177;0,050
|
Les enthalpies libres de Gibbs standard sont négatives,
ce qui laisse traduire la spontanéité du processus de partage du
cyanure entre la phase solide et la phase aqueuse.
ANNEXE
Synthèse des hormones
thyroïdiennes.
La synthèse des hormones
thyroïdiennes par la glande implique une prise de l'iode du sang et son
incorporation dans la glande thyroïdienne.
Figure i : Ci-dessous donne le
schéma de formation de l'hormone T4.
2I-++ Thyroïde peroxydase


Thyroglobuline
2I-++ Thyroïde peroxydase
+


Diiodotyrosine

Thyroxine (T4)
Figure 5. Allure de la droite de la variation de  par rapport à par rapport à
 , pour la
variété SADISA frais. , pour la
variété SADISA frais.

Figure 6. Allure de la droite de la
variation de  par
rapport à par
rapport à  , pour la variété SADISA sec.
, pour la variété SADISA sec.

Figure 7. Allure de la droite de la variation de  par rapport à par rapport à
 , pour la
variété MVUAMA sec. , pour la
variété MVUAMA sec.

CONCLUSION
Les études antérieures sur l'élimination
du cyanure dans le manioc ont démontré que la teneur en cyanure
dans le manioc varie d'une variété à l'autre. Cette teneur
varie d'une manière générale entre 15 et 400 mg de cyanure
par kilogramme de poids frais (Coursey) et de 30 à 100 mg de cyanure par
kilogramme de poids secs d'après Casadei.
Nos études sur les maniocs améliorés
provenant de l'INERA, Sadisa et Mvuama ont données les résultats
qui sont en accord avec les travaux antérieurs :
- SADISA (frais) : 398,106#177;0,303 mg de
CN-/kg ;
- SADISA (sec) : 189,946#177;0,303 mg de
CN-/kg ;
- MVUAMA (sec) : 163,926#177;0,303 mg de
CN-/kg.
Nous avons également mené une étude
cinétique pour déterminer la loi de vitesse (ordre de la
réaction et constante de vitesse) lié au processus
d'élimination. Il ressort de nos expériences que
l'élimination aqueuse du cyanure dans le manioc se comporte comme une
réaction d'ordre 1.
Puisque le cyanure est à l'origine de plusieurs
maladies dues à la carence en iode, nous avons également
déterminé le temps de demie vie (demie extraction) en milieu
fermé pour les espèces précitées.
- SADISA (frais) : 28,587 heures ;
- SADISA (sec) : 34,123 heures ;
- MVUAMA (sec) : 27,416 heures.
Ces données sont très importantes afin de
limiter le risque d'intoxication due au cyanure. Pour ce faire un trempage de 1
kg de ces variétés dans 5 litres d'eau et ce pendant au moins 72
heures baisse considérablement le taux du cyanure dans nos
variétés et ainsi le risque d'intoxication est
minimisé.
Les valeurs des constantes de partage et d'enthalpie libre
standard montrent que l'élimination du cyanure dans le manioc est un
processus spontané à partir du moment que l'action enzymatique a
pris fin.
Nous souhaitons voir cette étude poussée plus
loin par nos successeurs en vue d'effectuer une étude cinétique
enzymatique au sens stricte et de compléter par d'autres
expériences les autres paramètres thermodynamiques.
REFERENCES BIBLIOGRAPHIQUES
1. AUGER P.; GEMEK ET GAZIN M.; 1970: Encyclopédie
internationale des sciences et des techniques. Volume 4 Larousse. Presse de la
cité.
2. Asiedu J.J ; 1991 : La transformation des
produits agricoles en zone tropicale. Approche technologique. Version
française. Pp. 11-38. Editions Karthala et CTA.
3. BARAMPAMA A.; 1992: Le manioc en Afrique de l'Est.
Rôle et perspective dans le développement agricole. Editions
Karthala et IUED. 287 p.
4. BOURDOUX, MAFUTA, A. HANSON and A.M. ERMANS, Cassava
toxicity : the role of linamarin ottawa Ont. IDRC, 1980.
5. BRUDZYNSKI. A.; 1982: Nutrition et toxicologie. Exercice
N°8: Dosage des composés cyanogénétiques dans le
manioc. Inédit, Faculté des sciences. Université de
Kisangani.
6. COURSEY D.G., 1983: Cassava as food: toxicity and
technology: chonic cassava toxicity. Press. Interdisciplinary workshop.
7. DELANGE F.; ITEKE F.B. AND ERMANS A.M.; 1982: Nutritional
factors involved in the goitrogenic action of Cassava. OTTAWA, out, IDRC. 100
p.
8. DUFOUR D. L. ET WILSON W. M.; 1996: Les choix du manioc
amer en Amazonie: l'alimentation en forêt tropicale: interaction
bioculturelles et perspectives de développement volume II. Edition
UNESCO. pp 875-891.
9. FAO, 1970 Table de composition des aliments à
l'usage de l'Afrique. Rome-Italie.
10. GRACE; op.cit
11. KABENA NGADU; 2000: Contribution à la
détoxication des recettes à base de manioc (Manihot esculenta
CRANTZ). Inédit. Mémoire. Faculté des sciences.
Université de Kinshasa. 6p.
12. LUTETE M.L; 1994: Contribution à l'étude
des glucosides cyanogénétiques et des lectines des graines de
phosphocarpus scandens. Inédit. Mémoire. Section des
sciences Exactes. Institut Pédagogique National. 43 p.
13. MAKOSO N.; 1997: Evaluation préliminaire en champ
de collection de quelques variétés de manioc (Manihot
esculenta CRANTZ°. INEDIT. Mémoire. Faculté des
sciences agronomiques. Université de Kinshasa. 56 p.
14. Monique Larpent-Gourgaud et Jean-Jacques Sanglier; 1992:
Biotechnologies principes et methods. 425p.
15. OKE O. L., 1978: Problems in the use of cassava as animal
feed. Sci. Techn. Bot. 3(4): 345-380.
16. PIERRE SILVESTRE: Manuel pratique de la culture de manioc
éd. Maisonneuve et Larose 15, rue Victor-coucin 75005 Paris.
17. ROMAIN H. RAEMAEKERS. Agriculture en Afrique tropicale.
Direction générale de la coopération internationale
Ministère des affaires étrangères du commerce
extérieur et de la coopération internationale. Bruxelles,
Belgique.
18. RUKIYA R., 1988: Détermination quantitative du
cyanure dans le manioc (variétés F100, 02864, 30085/28, 30344/6
Mpelolongi). Inédit. Mémoire. Faculté des sciences,
Université de Kinshasa.
19. SKOOG, WEST, HOLLER : Chimie analytique, traduction
et révision scientifique de la septième édition
américaine par Claudine Buess-Herman, Josette D-W et Freddy D. De Boeck
University.
20. THILLY C. H. ; 1981: Goitre et crétinisme
endémiques. Rôle étiologique de la consommation de manioc
et stratégie d'éradication. Bulletin et mémoire de
l'Académie Royale de médecine en Belgique. pp 389-412.
21. VERVACK W.; 1982: Analyse des aliments. Facultés
des sciences agronomiques. Louvain la neuve. 96 p.
22. VOET D. ET VOET J. G.; 1998: Biochimie;
2ème édition. De Boeck Université, p. 514.
|
|